
JORGENSEN Christian (PU-PH)
BRONDELLO Jean-Marc (CR1/Inserm)
CHUCHANA Paul (CR1/CNRS)
VIGNAIS Marie-Luce (CR1/CNRS)
SANSALONI Audrey (IE, CDD)
LOIVET Marion (AI)
TACHIKART Yassin (PhD student)
MALAISE Olivier (Post-doc)
RACHIMBEAU Romain (master 2)
Cellules souches mésenchymateuses (CSM)
Mitochondries
Métabolisme énergétique
Cellules immunitaires ou cancéreuses
Interactions cellule-cellule
CSM âgées/sénescentes
Facteurs trophiques
Biologie cellulaire: culture de cellules souches mésenchymateuses humaines, coculture et mise en évidence de contacts cellule-cellule et transfert mitochondrial
Biochimie: ELISA, IF, Western blots
Mesures métaboliques: Seahorse, RT-qPCR
Biologie moléculaire: RT-qPCR, TLDA, Analyses transcriptomiques, qPCR sur ADN mitochondrial
Imagerie : microscopie confocale, bi-photon, time-lapse
Les cellules souches adultes participent à l’homéostasie tissulaire par l’intermédiaire de leurs interactions avec les cellules différenciées de ces tissus. Par ce dialogue, les cellules souches ajustent leur activité en réponse aux besoins des tissus afin de maintenir l’homéostasie ou, en cas de blessure, permettre la régénération tissulaire
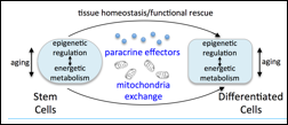
Au cours des dernières années, plusieurs laboratoires, y compris le nôtre, ont démontré la capacité de cellules souches mésenchymateuses (CSM) à interagir physiquement avec d’autres cellules par l’intermédiaire de nanotubes. Ce contact entraîne le transfert de mitochondries des CSM vers ces cellules cibles. L’acquisition des mitochondries des CSM entraîne la reprogrammation métabolique des cellules cibles et la modification de leurs fonctions cellulaires.
Dans le contexte des maladies dégénératives chroniques, l’utilisation de CSM en thérapie cellulaire anti-inflammatoire ouvre de grandes perspectives. Nous avons montré récemment que les CSM peuvent transférer leurs mitochondries à de cellules T in vitro. Notre objectif actuel est de déterminer comment le microenvironnement dégénératif inflammatoire peut modifier cette capacité de CSM à transférer des mitochondries aux cellules immunitaires ciblées et comment l’acquisition de mitochondries de CSM peut modifier la réponse immunitaire. Pour atteindre cet objectif, notre approche est double :
– Tout d’abord, déterminer les effets de l’inflammation systémique ou locale sur la capacité de CSM à transférer des mitochondries aux cellules immunitaires.
– Deuxièmement, déterminer la capacité des cellules immunitaires qui ont acquis des mitochondries de CSM à adapter leur phénotype par le biais d’une reprogrammation métabolique. Cette étude s’appuiera sur une analyse métabolique et phénotypique des cellules immunitaires suite à l’acquisition de mitochondries de CSM.
On sait que les CSM sont recrutées dans le microenvironnement tumoral où elles peuvent favoriser la progression tumorale et modifier la réponse des cellules cancéreuses aux traitements.
En utilisant des systèmes de co-culture entre les CSM de moelle osseuse humaine et une lignée cellulaire de cancer du sein (MDA-MB-231), nous avons montré que des nanotubes peuvent se former entre ces cellules et qu’ils permettent le transfert de mitochondries des CSM aux cellules cancéreuses. Nous avons conçu un protocole (MitoCeption) pour transférer des mitochondries, isolées des cellules “donneuses” (CSM), à des cellules cibles. Grâce à cette technique de MitoCeption, nous avons montré que l’acquisition des mitochondries de CSM par les cellules MDA-MB-231 augmente leur activité OXPHOS, la production d’ATP et leurs capacités de prolifération et d’invasion (Caicedo et al. Sci. Rep., 2015).
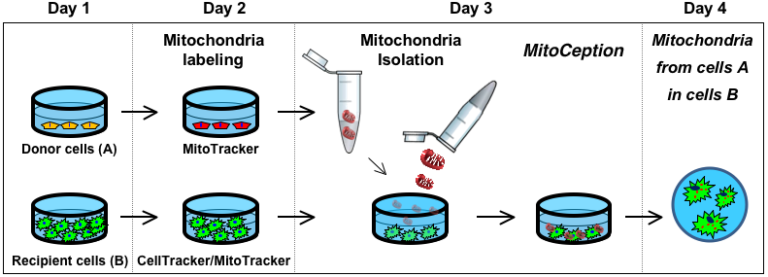
Sur la base de cette preuve de concept, nous avons centré notre recherche sur la pathologie du glioblastome. On sait en effet que les CSM sont recrutées dans ces tumeurs cérébrales. Nous avons développé un système de co-culture entre les cellules souches mésenchymateuses humaine (CSM) et des cellules souches de glioblastome (GSC) isolées de patients. Nous avons montré la formation de nanotubes entre CSM et GSC conduisant au transfert de mitochondries de CSM dans les GSC.
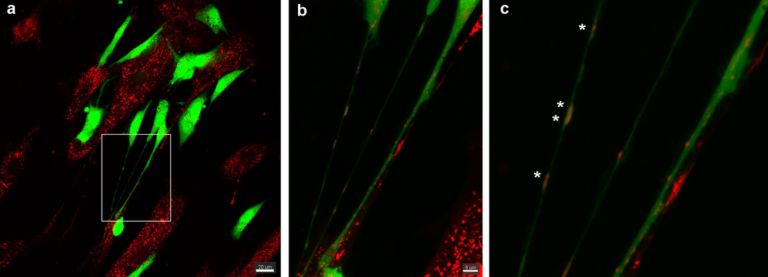
Nos objectifs actuels sont les suivants : (i) caractériser la dynamique de formation des nanotubes et de transfert de mitochondries entre CSM et GSC (approches microfluidiques), (ii) déterminer les effets des mitochondries de CSM sur le métabolisme et la réponse des GSC aux thérapies.
Le vieillissement est associé à une capacité réduite à maintenir l’intégrité de l’homéostasie tissulaire et la fonction, conduisant à une capacité altérée de réparation des tissus après une blessure. Le déclin de la fonction des cellules souches et de leur nombre est clairement associé au vieillissement des tissus. La comparaison entre les profils d’expression génique global de CSM humaines isolées de donneurs jeunes et âgés indique de profondes différences dans leurs transcriptomes respectifs. Parmi les gènes dont l’expression varie, nous avons identifié 31 gènes correspondant à des protéines sécrétées par les CSM et d’autres associés à la fonction mitochondriale des CSM (PRKAR2B, GPD1L, PTGS2, ACSL5, PLIN1). Au total, ces données suggèrent que le vieillissement des CSM impacte leur activité mitochondriale et leur dialogue paracrine avec d’autres cellules.
Nous vous proposons d’évaluer comment le vieillissement affecte le métabolisme énergétique des cellules souches et comment ces modifications affectent la fonction de soutien tissulaire des CSM.
– Nous identifierons les facteurs qui sont sécrétées de façon différente par les CSM âgées/sénescentes.
– Nous caractériserons ensuite l’impact de chaque facteur identifié sur les fonctions des CSM et leur capacité à transférer des mitochondries.
– Enfin, nous comparerons les conséquences des interactions des CSM avec les tissus environnants, selon l’état de vieillissement de CSM.
– Caicedo, A. et al. (2015). MitoCeption as a new tool to assess the effects of mesenchymal stem/stromal cell mitochondria on cancer cell metabolism and function. Sci Rep 5, 9073.
– Escobar, P. et al. (2015). IL-1β produced by aggressive breast cancer cells is one of the factors that dictate their interactions with mesenchymal stem cells through chemokine production. Oncotarget 6, 29034-47.
– Djouad, F. et al. (2014). Promyelocytic leukemia zinc-finger induction signs mesenchymal stem cell commitment: identification of a key marker for stemness maintenance? Stem Cell Res Ther 5, 27.
– Guerit, D. et al. (2014). FoxO3a regulation by miRNA-29a controls chondrogenic differentiation of mesenchymal stem cells and cartilage formation. Stem Cells Dev 23, 1195-1205.
– Hamidou Soumana, I. et al. (2014). Midgut expression of immune-related genes in Glossina palpalis gambiensis challenged with Trypanosoma brucei gambiense. Front Microbiol 5, 609.
– Mathieu, M. et al. (2014). Involvement of Angiopoietin-like 4 in Matrix Remodeling during Chondrogenic Differentiation of Mesenchymal Stem Cells. J Biol Chem 289, 8402-8412.
– Philipot, D. et al. (2014). p16INK4a and its regulator miR-24 link senescence and chondrocyte terminal differentiation-associated matrix remodelling in osteoarthritis. Arthritis Research & Therapy 16, R58.
– Garcin, G. et al (2013). Differential activity of type I interferon subtypes for dendritic cell differentiation. PLoS One 8, e58465.
– Guerit, D et al. (2013). Sox9-regulated miRNA-574-3p inhibits chondrogenic differentiation of mesenchymal stem cells. PLoS One 8, e62582.
– Lopez-Mejia, I. C. et al. (2013). Tissue-specific and SRSF1-dependent splicing of fibronectin, a matrix protein that controls host cell invasion. Mol Biol Cell 24, 3164-3176.
– Basbous, J. et al. (2012). Induction of ASAP (MAP9) contributes to p53 stabilization in response to DNA damage. Cell Cycle 11, 2380-2390.
– Fritz, V. et al. (2011). Bone-metastatic prostate carcinoma favors mesenchymal stem cell differentiation toward osteoblasts and reduces their osteoclastogenic potential. J Cell Biochem 112, 3234-3245.
Pour plus de références, cliquez sur PubMed: