
CROZET Carole (CR1/INSERM)
LEHMANN Sylvain (PU-PH UM/CHU)
HIRTZ Christophe (MCU/UM)
DELABY Constance (MCU/UM)
GABELLE Audrey (MCU-PH UM /CHU)
MONZO Cécile (TR/UM)
TIERS Laurent (IE/CHU)
RADREAU Félicie (Doctorante/UM)
AUBOYER Laura (Doctorante/UM)
LESOUDER Cosette (Doctorante/UM)
BROS Pauline (Doctorante/UM)
Prion
Creutzfeldt-Jacob
Alzheimer
Maladies neurodégénératives
Cellules souches neurales (NSC)
Cellules souches embryonnaires humaine (hESC)
Cellules souches pluripotentes induite (iPS)
Tau
Aβ
Thérapie cellulaire
Neurogenèse adulte
Culture cellulaire: cellules souches embryonnaires murines, cellules souches embryonnaires humaines, cellules souches neurales fœtales murines/ humaines, cellules souches neurales adultes, reprogrammation en cellules iPS, fibroblastes embryonnaires murins (MEF), cultures organotypiques
Biochimie/protéomique: Western Blot, gels-2D, ELISA simplex/multiplexe (Technologie Mesoscale Discovery), LC-MS/MS
Biologie Moléculaire: Clonage de gène, RT-Q-PCR
Cytologie: Immunofluorescence, Immunohistochimie
Expérimentation animale: Modélisation des maladies à prions
Les maladies à prions sont caractérisées par l’accumulation d’une protéine prion pathologique (PrPSc) qui provient de la conversion de la protéine normale (PrPC). A l’heure actuelle il n’y a pas de traitement disponible pour ces maladies. Nous développons un nouvelle approche de thérapie génique et cellulaire en utilisant (i) des lentivirus exprimant des mutants dominants-négatifs de la PrP (PrP-DN) qui préviennent le développement des affections à prions et (ii) des cellules souches neurales obtenues à partir de cellules souches embryonnaires exprimant, via ces lentivirus, les PrP-DN. Notre approche de « médecine régénérative » a pour objectif d’utiliser des cellules saines comme « médicament » pour remplacer les cellules détruites et délivrer en même temps des molécules anti-prion (figure 1).
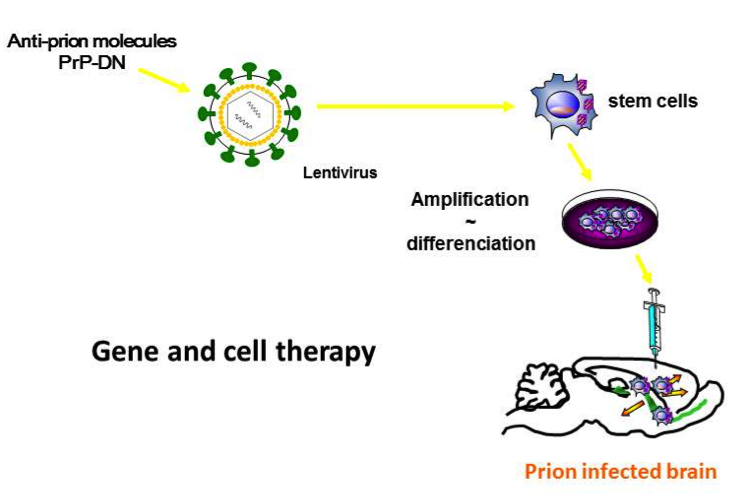
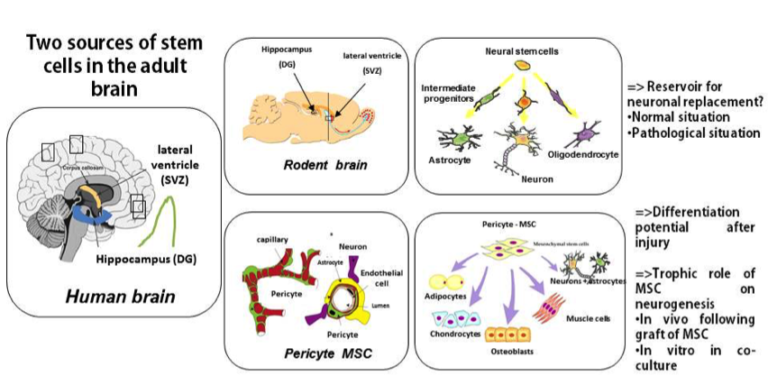
Un aspect complémentaire à ces recherches porte sur la neurogenèse adulte dont la compréhension est importante pour optimiser les greffes et qui en soit possède des perspectives thérapeutiques pour traiter les maladies neurodégénératives. Nous avons montré une co-localisation des prions avec les neuroblastes et les cellules souches neurales (CSN) adultes des zones neurogéniques. Cette observation est appuyée par des résultats montrant que les CSN adultes répliquent l’agent du prion (Relano-Gines et al., 2013). En parallèle, nous cherchons à évaluer, grâce à des analyses histologiques cinétiques chez la souris infectée par des prions, le statut de cette neurogenèse adulte au cours de la maladie. Ceci est essentiel pour définir avec exactitude la fenêtre thérapeutique optimale des greffes de CSE et si la neurogenèse adulte est plutôt protectrice ou contribue à la pathologie. Depuis peu nous cherchons également à savoir si les pericytes-MSC-like présents dans le cerveau adulte sont affectées au cours du processus pathologique (figure 2).
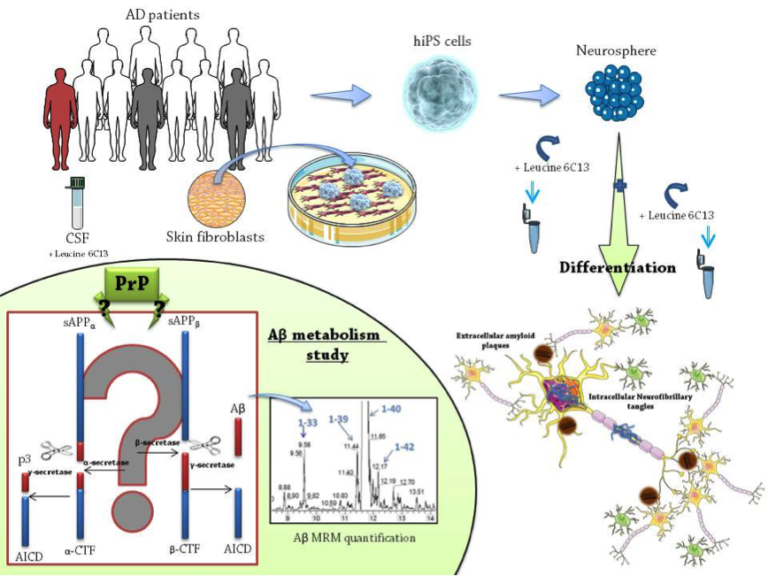
Notre programme nous a amenés à développer des outils protéomiques (analyses multiplexe, 2D, spectrométrie de masse) maintenant intégrés dans le laboratoire de Biochimie-Protéomique Clinique de l’IRMB. Dans ce cadre nous participons à plusieurs projets destinés à trouver des biomarqueurs caractéristiques de différentes situations pathologiques. Nous travaillons principalement sur les démences dont font partie les maladies à prions et la maladie d’Alzheimer. Le diagnostic biologique de ces affections est en effet réalisé au laboratoire sur du LCR, et notre but est de trouver des biomarqueurs précoces et/ou très spécifiques. Nous avons publié en 2011 des résultats sur les biomarqueurs d’intérêt clinique dans les démences et dans la maladie d’Alzheimer (Gabelle, 2011). Nous avons également fait le point sur l’utilisation de la spectrométrie de masse quantitative en biochimie clinique (Lehmann, 2011). Par ailleurs, pendant des années, les études moléculaires et cellulaires portant sur l’apparition, les modifications pathologiques et le métabolisme de l’APP et de Tau ont été freinées par le manque de modèles cellulaires pertinents, jusqu’à la mise au point révolutionnaire de cellules souches pluripotentes induites dites « reprogrammées ». Nous proposons de générer de telles cellules souches « reprogrammées » à partir de cellules de patients MA dans le but d’étudier le métabolisme et améliorer notre compréhension des modifications que subissent l’APP et Tau ainsi que le rôle de la PrP dans ces processus. Cet outil présente une opportunité unique de modéliser in vitro le phénotype de la MA et d’apporter non seulement de nouvelles connaissances sur les causes de la maladie mais aussi la possibilité d’identifier de nouvelles cibles thérapeutiques (figure 3). suggérant ainsi un rôle anti-amyloïdogénique de la PrP. D’autres études proposent cependant la PrP comme le récepteur principal et médiateur pathologique des oligomères Aβ à la surface neuronale induisant notamment l’inhibition des LTP, l’altération synaptique, et l’altération de la mémoire voire même l’hyperphosphorylation de Tau. Certaines de ces modifications pathologiques seraient le résultat d’altération de la voie de signalisation impliquant la kinase Fyn, elle-même régulée par la PrP. Une meilleure compréhension des interactions, PrP, APP et Tau apparaît désormais indispensable pour pouvoir démanteler les mécanismes physiopathologiques moléculaires de la MA (figure 4).
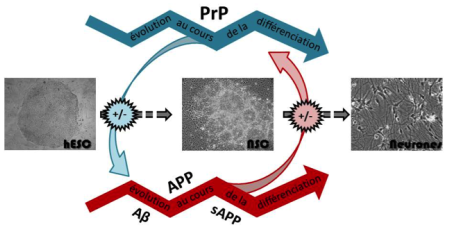
2015
– Bros P et al. Quantitative detection of amyloid-β peptides by mass spectrometry: state of the art and clinical applications. Clin Chem Lab Med. 2015 Feb 18. pii: /j/cclm.ahead-of-print/cclm-2014-1048/cclm-2014-1048.xml. doi: 10.1515/cclm-2014-1048.
2014
– Lehmann S. et al (2014) A diagnostic scale for Alzheimer’s disease based on cerebrospinal fluid biomarker profiles. Alzheimer’s Research & Therapy 6:38 [IF=3,5]
– Lehmann S et al. (2014) Can we rely only on ratios of cerebrospinal fluid biomarkers for AD biological diagnosis? Alzheimers Dement. In press [IF= 14.48]
– Lehmann S et al. (2014) Systemic delivery of siRNA down regulates brain prion protein and ameliorates neuropathology in prion disorder. PLoS One. Feb 14;9(2):e88797. doi: 10.1371/journal.pone.0088797. eCollection 2014. [I.F = 4.24]
– Relaño-Ginés A et al. (2014) Prion diseases and adult neurogenesis: How do prions counteract the brain’s endogenous repair machinery? Prion. 2014 May 15;8(3). [IF=2,33]
– Barthelemy N et al. (2014) “Detection and Quantification of the Tau Protein and Its Isoforms in the Csf of Alzheimer’s Disease Patients Using Mass Spectrometry.” Alzheimer’s & Dementia 10, no. 4 sup: 147. [IF= 14.48]
2013
– Van der Laan S et al. (2013) High Dub3 expression in mouse ESCs couples the G1/S checkpoint to pluripotency. Mol Cell. Nov 7;52(3):366-79. doi: 10.1016/j.molcel.2013.10.00 [IF= 14.464].
– Relaño-Ginès A et al. (2013) Prion replication occurs in endogenous adult neural stem cells and alters their neuronal fate. Involvement of endogenous neural stem cells in prion diseases Plos Pathog 9(8):e1003485. doi: 10.1371/journal.ppat.1003485 [IF= 9.13].
– Lehmann S et al. (2013) Impact of harmonisation of collection tubes on Alzheimer’s disease diagnosis Alzheimers Dement. Oct;10(5 Suppl):S390-S394.e2. doi: 10.1016/j.jalz.2013.06.008. Epub 2013 Oct 23. [IF= 14.483]
– Lesage S et al. (2013). C9orf72 repeat expansions are a rare genetic cause of parkinsonism. Brain 136(Pt 2):385-91. [IF= 9,457]
– Lehmann S et al. (2013) “Quantitative Mass Spectrometry (Srm/Mrm) for Amyloid Peptides, Tau Protein and Apolipoprotein E in Human Cerebrospinal Fluid for Alzheimer’s Disease Diagnosis.” Alzheimer’s & Dementia 4, no. 9 sup: 212. [IF= 14.48]
– Dumurgier J et al. (2013) Exacerbated CSF abnormalities in younger patients with Alzheimer’s disease. Neurobiol Dis. 2013 Feb 13. doi:pii: S0969-9961(13)00062-4. [IF=5.04]
– Lehmann S et al. (2013) Current and future use of “Dried Blood Spot” analyses in clinical chemistry. Clin Chem Lab Med In press [IF=2.15]
2012
– Perret-Liaudet A et al. (2012) Cerebrospinal Fluid Collection Tubes: a critical issue for Alzheimer Disease diagnosis Clin Chem. 58, 787-9 [IF= 6.89]
– Dumurgier J et al. (2012) Intersite variability of CSF Alzheimer’s disease biomarkers in clinical setting. (2012) Alzheimers Dement. 2012 Nov 7. doi:pii: S1552-5260(12)02381-3 [IF= 14.483]
– Gabelle A, et al. (2012) Impact of the 2008-2012 French Alzheimer Plan on the use of CSF biomarkers in Research Memory Center: The PLM study (2012) J Alzheimers Dis. 2012 Nov 27. [IF= 4.26]
– Perret-Liaudet A et al. (2012) Risk of Alzheimer’s Disease biological misdiagnosis linked to cerebrospinal collection tubes J Alzheimers Dis. 31, 13-20. [IF= 4.26]
– Roche S et al. (2012) Comparative analysis of protein expression of three stem cell populations: Models of cytokine delivery system in vivo (2012) Int J Pharmaceut 440, 72-82 [IF=3.61]
– C. Delaby et al. Biogenesis of a phagosome containing a senescent red blood cell: cellular evidences of heme catabolism outside the erythrophagolysosome. PLoS One 2012;7(7):e42199. [IF=4,35]
– Renard D et al. (2012) Interest of CSF biomarker analysis in possible cerebral amyloid angiopathy cases defined by the modified Boston criteria. J Neurol. 259, 2429-33. [IF=3.85]
– Lehmann S et al. (2012) Quantitative Clinical Chemistry Proteomics (qCCP) using mass spectrometry: general characteristics and application. Clin Chem Lab Med 23, 1-16 [IF=2.15]
2011
– Relaño-Gines A et al. (2011) Stem cell therapy extends incubation and survival time in prion infected mice in a time window-dependant manner. J Infect Dis. 204, 1038-45. [IF=6,29] See editorial commentary: Is There Still Hope After Prions Have Spread Within the Brain?
– Lapasset L et al. (2011) Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-53. [IF=12,89]
– J. To-Figueras et al. ALAS2 acts as a modifier gene in patients with congenital erythropoietic porphyria. Blood. 2011 Aug 11;118(6):1443-51. [IF=10,56].
– Gabelle A et al. (2011) Decreased sAβPPβ, Aβ38 and Aβ40 cerebrospinal fluid levels in Frontotemporal Dementia. J Alzheimers Dis. Jan 1;26(3):553-63. [IF= 4.26]
– Provansal M et al. (2011) Two Dimensional Gel Electrophoresis Analysis of Mesenchymal Stem Cells. Methods Mol Biol. 2011;698:431-442. [IF=6.52]
– Delmouly K et al. (2011) HEPES inhibits the conversion of the Prion protein in cell culture. J Gen Virol. 92:1244-50. Epub 2011 Feb [IF=3.57]
– Ayrolles-Torro A et al. (2011) Oligomeric-induced activity by thienyl pyrimidine compounds traps prion infectivity J of Neuroscience 31:14882-92 [IF=7.27]
– C. Delaby et al. Role of two nutritional hepatic markers (insulin-like growth factor 1 and transthyretin) in the clinical assessment and follow-up of AIP patients. J. Intern med. 2009 Sept; 266 (3): 277-85. [IF=5,93]
– Lehmann S et al. (2011) From “Clinical Proteomics” to “Clinical Chemistry Proteomics”; considerations using Quantitative mass-spectrometry as a model approach Clin Chem Lab Med 50:235-42 [IF=2.15]
2010
– Gabelle A et al. (2010) Correlations between soluble a/b forms of amyloid precursor protein and Aβ38, 40 and 42 in human cerebrospinal fluid. Brain Res. 1357, 175-83. [IF=2.62]
– Provansal M et al (2010) Proteomic consequences of expression and pathological conversion of the prion protein in inducible neuroblastoma N2a cells. Prion 4, 292-301. [IF=2.47]
– Betsou F et al. International Society for Biological and Environmental Repositories (ISBER) Working Group on Biospecimen Science. (2010) Standard preanalytical coding for biospecimens: defining the sample PREanalytical code. Cancer Epidemiol Biomarkers 19, 1004-11. [IF=4.89]
– Gras D et al (2010) Regulation of CXCR/IL-8 in human airway epithelial cells. Int Arch Allergy Immunol 152, 140-50. [IF=2.54]
2009
– Roche S et al. (2009) Comparative proteomic analysis of human mesenchymal and embryonic stem cells: towards the definition of a mesenchymal stem cell proteomic signature. Proteomics 2, 223-32. [IF=4,43]
– Relaño-Gines A et al. (2009) Gene and cell therapy for prion diseases. Infect Disord Drug Targets. 1, 58-68. [IF=3,93]
– Roche S. et al. (2009) Depletion of one, six, twelve or twenty major blood proteins before proteomic analysis: the more the better? J Proteomics 72, 945-51. [IF=3,85]
– Lehmann S et al. (2009) New hospital disinfection processes for both conventional and prion infectious agents compatible with thermo-sensitive medical equipments. J Hosp Inf 72, 342-350. [IF=3,01]
– Segarra C et al. (2009) Prion protein expression and processing in human mononuclear cells. PLoS One 4(6):e5796. [IF=4,35]
– Betsou F et al. (2009) Human Biospecimen Research: Experimental Protocol and Quality Control Tools. Cancer Epidemiol Biomarkers Prev. 18, 1017-25. [IF=4.89]
2008
– Chasseigneaux S et al. (2008) Genetic heterogeneity versus molecular analysis of prion susceptibility in neuroblasma N2a sublines. Arch. Virol. 153, 1693-702.. . [IF=1,91]
– Beranger F. et al. (2008) Trehalose impairs aggregation of PrPSc molecules and protects prion-infected cells against oxidative damage. Biochem Biophys Res Commun. 374, 44-8. [IF=2,55]
– Mouillet-Richard S et al. (2008) Prions impair bioaminergic functions through serotonin- or catecholamine-derived neurotoxins in neuronal cells. J Biol Chem. 283, 23782-23790. [IF=5,33]
– Toupet K et al. Effective gene therapy in a mouse model of prion diseases. (2008) PLoS One. 23;3(7) E2773 [IF=4,35]
– Roche S et al. (2008) Auto-antibody profiling on high-density protein microarrays for biomarker discovery in the cerebrospinal-fluid. J Immunol Methods 338, 75-8. [IF=2,29]
– Roche S et al. (2008) Clinical Proteomics of the Cerebrospinal Fluid: towards the discovery of new biomarkers. Proteomics Clin Appl. 2, 428–436. [IF=1,88]
– C. Delaby et al. Sequential regulation of ferroportin expression after erythrophagocytosis in murine macrophages: early mRNA induction by haem, followed by iron-dependent protein expression. Biochem J. 2008 Apr 1;411(1):123-31. [IF=5,02]
– Alais S et al. (2008) Mouse neuroblastoma cells release prion infectivity associated with exosomal vesicles. Biol Cell. 100, 603-15. [IF=3,97]
– Crozet C et al. (2008) Cellular pathogenesis in prion diseases. Vet Res. Jul-Aug;39(4):44. [IF=3,58]
– Noel D et al. (2008) Cell specific differences between human adipose derived- and mesenchymal- stromal cells despite similar differentiation potentials. Exp Cell Res. 314, 1575-84. [IF=3,59]
– Encalada S.E. et al. (2008) The Role of the Prion Protein in the Molecular Basis for Synaptic Plasticity and Nervous System Development. J Mol Neurosci 34, 9-15. [IF=2,72]
– Kastrinaki MC. et al. (2008) Functional, Molecular and Proteomic Characterization of Bone Marrow Mesenchymal Stem Cells in Rheumatoid Arthritis. Ann Rheuma Dis 67, 741-9. [IF=8.73]
Pour plus de références, cliquez sur PubMed: